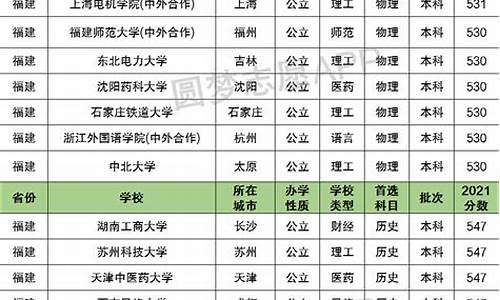
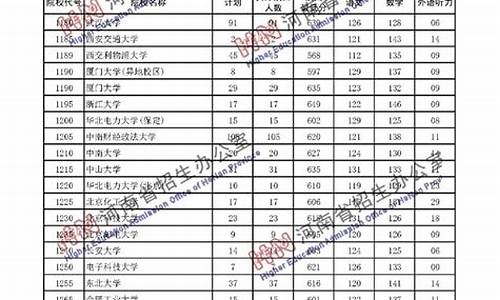
2015小高考化学答案,2021年小高考化学试卷
1.求高二化学重要金属,单质,气体,化合物的性质,反应方程式,离子方程式(江苏小高考)

高中化学合集百度网盘下载
链接:提取码:1234
简介:高中化学优质资料下载,包括:试题试卷、课件、教材、视频、各大名师网校合集。
求高二化学重要金属,单质,气体,化合物的性质,反应方程式,离子方程式(江苏小高考)
生产1.38吨NaNO2时,n(NaNO2)=
1.38×106g69g/mol=2×104mol,NaNO2、NaNO3两种产品的物质的量之比为2:1,则n(NaNO3)=1×104mol,由Na原子守恒可知,2n(Na2CO3)=n(NaNO2)+n(NaNO3),m(Na2CO3)=(2×104mol+1×104mol)×
12×106g/mol=1.59×106g=1.59t,
故答案为:1.59.
考查点6 金属及其化合物
一、钠的单质及其化合物的性质:
1.钠的物理性质:银白色固体、质软、密度比水小、熔点低(97℃)。
2. 钠的化学性质:
(1)与氧气反应:常温下4Na +O2 ==== 2Na2O (白色);
加热下 2Na +O2 ==== 2Na2O2(淡**)
(2)与水反应:现象:“浮—熔—游—响—红”。
解释:钠浮在水面上,熔成小球,在水面上四处游动,发出“嘶嘶”的响声,烧杯中的溶液加入酚酞后变红。
原因:浮—钠的密度比水小。
熔—熔成光亮的小球,因为钠的熔点低,且该反应放热。
游—反应有气体产生。
响—反应剧烈,有气体生成。
红—生成碱性物质。
化学方程式:2Na +2H2O ====2NaOH + H2↑
氧化剂:______________,还原剂:_____________________.
离子方程式:2Na+2H2O === 2Na++ 2OH—+ H2↑
补充:①把钠投入到CuSO4溶液中:钠先与水反应,生成的NaOH再与CuSO4反应。
2Na +2H2O ====2NaOH + H2↑,2NaOH+ CuSO4==Cu(OH)2↓+Na2SO4
②把钠投入到FeCl3溶液中:钠先与水反应,生成的NaOH再与FeCl3反应。
2Na +2H2O ====2NaOH + H2↑,3NaOH+ FeCl3==Fe(OH)3↓+3NaCl
3.钠的氧化物
(1)氧化钠-- Na2O(白色固体)
Na2O+H2O === 2NaOH(Na2O是碱性氧化物)
(2)过氧化钠-- Na2O2(淡**的固体)
2Na2O2 +2H2O === 4NaOH +O2↑ (Na2O2既是氧化剂又是还原剂)
2Na2O2 +2CO2 === 2Na2CO3 + O2 (Na2O2既是氧化剂又是还原剂)
过氧化钠的用途:(1)用于呼吸面具或潜水艇中作为氧气的来源。(供氧剂)
(2)强氧化性。(漂白性)
4. 碳酸钠和碳酸氢钠
Na2CO3
NaHCO3
溶解性
易溶(溶解性:Na2CO3 ﹥NaHCO3)
易溶
热稳定性
稳定[来源:学科网]
不稳定
2NaHCO3△Na2CO3+CO2↑+H2O
碱性
碱性(相同浓度时,
碱性:Na2CO3 ﹥NaHCO3)
碱性
盐酸
Na2CO3+2HCl=2NaCl+H2O+CO2↑
比碳酸钠与盐酸反应剧烈[来源:学N
NaHCO3科+HCl=NaCl+H2O+CO2↑
二、铝、氧化铝、氢氧化铝的有关化学性质:
1.铝的性质:(书P51)
2Al + 6HCl == 2AlCl3 + 3H2↑
离子反应方程式:2Al + 6 H+== 2Al3++3H2↑
2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑
离子反应方程式:2Al + 2OH—+ 2H2O ==2AlO2—+3H2↑
2. 氧化铝的性质:(P58)
(1)物理性质:难溶于水,熔点高,硬度大。
(2)化学性质----两性氧化物(既能与酸反应,又能与强碱反应,只生成盐和水的氧化物。)
Al2O3 + 6HCl == 2AlCl3 + 3 H2O
离子反应方程式:Al2O3 + 6 H+== 2Al3+ + 3 H2O
Al2O3 + 2 NaOH== 2NaAlO2 + H2O
离子反应方程式Al2O3 + 2OH— ==2AlO2— + H2O
3. 氢氧化铝的性质:
(1)物理性质:不溶于水的白色沉淀。
(2)化学性质---两性氢氧化物(既能与酸反应,又能与强碱反应,只生成盐和水的氧化物)
Al (OH)3 + 3 HCl == AlCl3 + 3 H2O
离子反应方程式:Al (OH)3 + 3 H+== Al3+ + 3 H2O
Al (OH)3 + NaOH == NaAlO2 + 2 H2O
离子反应方程式:Al (OH)3 + OH— ==AlO2— + 2 H2O
(3)氢氧化铝的实验室制法 :可溶性铝盐溶液和氨水反应制取氢氧化铝
Al2(SO4)3+6NH3·H2O==2Al(OH)3↓+3(NH4)2SO4 (NH3·H2O是弱碱,写离子方程式时,不能拆)
离子方程式:Al3++3NH3·H2O==Al (OH)3↓+3NH4+
(4)Al(OH)3 不稳定性:2 Al(OH)3 ==== Al2O3 + 3 H2O
三、铁及其化合物的性质:
1.单质铁高温下与水蒸气反应:(P51) 3Fe + 4H2O(g)====Fe3O4 + 4H2
2.铁的重要化合物(P59)
(1)物理性质:Fe2O3是一种红棕色粉末,俗称铁红;Fe3O4是磁性的黑色晶体,俗称磁性氧化铁。
(2)化学性质:
① 氢氧化亚铁易被空气中氧气氧化:4 Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
[关注颜色:白色沉淀迅速转变为灰绿色最后变成红褐色]
② Fe(OH)3 不稳定性:2 Fe(OH)3 ==== Fe2O3 + 3 H2O
③铁盐和亚铁盐(P61)
Fe3+的检验:遇硫氰化钾(KSCN),溶液呈血红色。(Fe3+与SCN-不能共存)
FeCl3 变为FeCl2:
2FeCl3 + Fe == 3FeCl2
离子方程式:2Fe3+ + Fe == 3Fe2+
2FeCl3 +Cu == 2FeCl2 + CuCl2
离子方程式:2Fe3+ +Cu == 2Fe2+ + Cu2+
FeCl2变为FeCl3: 2FeCl2 + Cl2 ==2FeCl3
离子方程式:2Fe2+ + Cl2 == 2Fe3+ + 2Cl—
四.合金:合金比构成它的纯金属硬度大,熔点低。
考查点7非金属及其化合物
一、硅
1. SiO2(1)物理性质:不溶于水,熔点高,硬度大。
(2) 化学性质:(P76)
SiO2+2NaOH ==Na2SiO3+H2O (实验室碱性溶液不能用玻璃塞,要用橡皮塞)
离子方程式:SiO2+2OH- ==SiO32-+H2O
SiO2与氢氟酸:SiO2+4HF=SiF4↑+2H2O(用HF来雕刻玻璃)
2.硅酸(H2SiO3)(P76-77)
(1)物理性质:不溶于水的弱酸。酸性:H2SiO3﹤H2CO3
(2)实验室制硅酸:Na2SiO3+2HCl==H2SiO3↓+2NaCl(反应原理:强酸制弱酸)
补充:硅酸钠溶液放在空气中变质的原因:Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3
3.硅酸盐
Na2SiO3:可溶于水,其水溶液俗称水玻璃,是一种黏性很强的矿物胶。
三大传统硅酸盐产品:水泥、玻璃、陶瓷。
制陶瓷的原料:黏土。
制水泥的原料:黏土和石灰石(CaCO3)
制玻璃的原料:纯碱,石灰石,石英
普通玻璃的成分:Na2SiO3、CaSiO3、SiO2。
4.硅单质
(1)物理性质:带有金属光泽的灰黑色固体,熔点高,硬度大。(类似金刚石)
它的导电性介于导体和绝缘体之间,是良好的半导体材料。
(2)化学性质:很稳定。
二、氯气的性质
1. 氯气(1)物理性质:黄绿色、有刺激性气味的有毒气体、密度比空气大、能溶于水。
(2)化学性质:
①与大多数金属(钠,铜,铁反应 ):
2Na+Cl2 = 2NaCl Cu+Cl2 = CuCl2 2Fe+3Cl2 = 2FeCl3
②与氢气反应:H2+Cl2 = 2HCl(瓶口产生白雾)
燃烧的定义:任何发光发热的剧烈的化学反应都是燃烧。燃烧不一定要有氧气参加。
③ 与水反应:Cl2+H2O = HCl+HClO(Cl2既是氧化剂又是还原剂)
离子方程式:Cl2+H2O = H++Cl-+HClO
HClO的三大特性:弱酸性:酸性HClO﹤H2CO3
不稳定性: 2HClO=== 2HCl+O2↑
强氧化性(杀菌、消毒、漂白,例如:能使有色布条褪色)
新制氯水的成分:Cl2、H2O、HClO、H+、Cl-、ClO-。
久制氯水的成分:H+、Cl-、H2O。
④与碱反应:Cl2+2NaOH = NaCl+NaClO+H2O(漂白液的有效成分)
(尾气吸收:用NaOH溶液吸收多余氯气)
离子方程式:Cl2+2OH- = Cl-+ ClO-+H2O
2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O (漂白粉的有效成分)
漂白粉漂白原理或久置失效的原因: Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO
2. 氯离子(Cl-)的检验
检验试剂:稀硝酸(HNO3)、硝酸银(AgNO3)
现象:产生白色沉淀(AgCl)。(HNO3的作用:酸化溶液,排除CO32-的干扰)
三、硫和氮的氧化物
1.二氧化硫和三氧化硫
(1)单质硫:俗称硫黄,不溶于水,微溶于酒精,易溶于CS2。
(2)二氧化硫的性质:(书P90)
①物理性质:无色、有刺激性气味的有毒气体、密度比空气大、易溶于水。
②化学性质:
SO2的漂白原理:SO2与某些有色物质化合生成无色不稳定的物质,这些无色不稳定的物质受热易分解,又恢复原来的颜色。
鉴别SO2与CO2的最好的方法:用品红溶液。(SO2能使品红褪色,CO2不能使品红褪色)
(i)酸性氧化物的通性:(有些与水反应、与碱反应、与碱性氧化物反应)
SO2+H2O====H2SO3(可逆反应:同一条件下,既能向正反应方向发生,又能向逆反应方向进行的反应。)
SO2+Ca(OH)2==CaSO3↓+ H2O(SO2也能使澄清石灰水变浑浊)
SO2+CaO==CaSO3
(ii)还原性:2SO2+ O2 === 2SO3
(3)三氧化硫的性质:
①物理性质:常温下是一种无色的、易挥发的晶体。
②化学性质(酸性氧化物的通性):SO3 +H2O = H2SO4
SO3+Ca(OH)2==CaSO4↓+ H2O
SO3+CaO==CaSO4
2.二氧化氮和一氧化氮
(1)一氧化氮(NO)
①物理性质:无色气体,不溶于水。
②化学性质:N2+O2 ==== 2NO,2NO+O2=2NO2(红棕色)
(2)二氧化氮(NO2)
①物理性质:红棕色、有刺激性气味的有毒气体,密度比空气大,易溶于水。
②化学性质: 3NO2+H2O=2HNO3+NO↑(NO2既是氧化剂,又是还原剂)
雷雨发庄稼: N2+O2 = 2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO↑
3. 二氧化硫和二氧化氮对大气的污染
酸雨(PH﹤5.6)
(1)引起酸雨的气体:SO2 和NO2。
(2)酸雨的形成原因:
2SO2+ O2 === 2SO3 ,SO3 +H2O = H2SO4或SO2+H2O====H2SO3,2H2SO3+ O2 ====2H2SO4
3NO2+H2O=2HNO3+NO↑
(3)酸雨的成分:HNO3和H2SO4。
四、氨、硝酸、硫酸
1.氨的性质: 工业合成氨:N2+3H2 === 2NH3
(1)物理性质:无色、有刺激性气味的气体、极易溶于水。
(因为极易溶于水,NH3可作喷泉实验,烧瓶内外产生压力差)
(2)化学性质:
①与水反应:NH3+H2O ===NH3.H2O(氨水有弱碱性)
②与酸反应:NH3+ HCl == NH4Cl(大量白烟) NH3+HNO3==NH4NO3(大量白烟)
2NH3+H2SO4===(NH4)2SO4(无白烟)
铵盐的性质:(1)物理性质:极易溶于水。
(2)化学性质:
①铵盐受热分解(不稳定性):NH4Cl = NH3+HCl
NH4HCO3 = NH3↑+H2O+CO2↑
②铵盐与碱反应:NH4NO3+NaOH===NaNO3+H2O+NH3↑
铵离子的检验:NH4++OH-==H2O+NH3↑(湿润红色石蕊试纸变蓝)
实验室制氨气:2NH4Cl+Ca(OH)2 === CaCl2+2NH3↑+2H2O (无离子反应)
反应原理:铵盐与碱的固体加热
装置:固体+固体→
收集:向下排空气法
检验:用湿润的红色石蕊试纸变蓝
或者用蘸有浓HCl的玻璃棒放在试管口检验,冒白烟。
干燥:碱石灰或生石灰。
尾气处理:用水吸收。(NH3极易溶于水)
2.硫酸和硝酸的氧化性
(1)硫酸的性质:
①物理性质:是一种无色、黏稠的液体,浓H2SO4的质量分数为98%,其密度为1.84g/m3,其物质的量浓度为18.4mol/L.硫酸是一种高沸点、难挥发的酸。
②化学性质:(i)酸的通性:H2SO4===2H++SO42-
(ii)浓H2SO4的三大特性:
吸水性:能吸收游离态的水或化合物中的结晶水,可用来作干燥剂。
例如:干燥SO2、O2、Cl2、NO等。
脱水性:将有机物中H和O按原子个数比2:1脱出,生成水(H2O)。
例如:蔗糖的“黑面包”实验。C12H22O11 →12C+11H2O
强氧化性:(浓H2SO4与金属或者非金属反应,生成SO2)
例如:Cu+2H2SO4(浓)== CuSO4+ SO2↑+H2O (浓H2SO4体现强氧化性和酸性)
(生成的SO2用品红溶液检验:红色褪成无色或者用紫色石蕊溶液,变红)
C+ 2H2SO4(浓) == CO2↑+ 2SO2↑+2H2O(浓H2SO4体现强氧化性)
(2)硝酸的性质:
铜与浓硝酸:Cu+4HN03(浓) = Cu(NO3)2+2NO2↑+2H20(浓HN03体现强氧化性和酸性)
铜与稀硝酸:3Cu+8HN03(稀) = 3Cu(NO3)2 +2NO↑+4H20(稀HN03体现强氧化性和酸性)
小结:①浓H2SO4参加反应,产物是SO2.
②浓HN03参加反应,产物是NO2.,
③稀HN03参加反应,产物是NO。
钝化:铁、铝遇到冷的浓硫酸或浓硝酸,表面生成致密的氧化物薄膜,阻碍了反应的进一步进行。(属于化学变化)
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。